По материалам участников премии Люсьяна Майе, онко-радиотерапевта Идрисса Труссье и Александра Фалка.
Эффективность лечения онкологии если лечение проводить одновременно радио и иммунотерапией. Новый многообещающий протокол лечения.
Почему радиотерапия не всегда эффективна и каким образом иммунитет связан с эффективностью радиотерапии? Почему лучевая терапия не может быть сведена к простому повреждению ДНК клеток?
Канцерогенез и иммунитет.
Онкогенез это появление раковых клеток. С 2000 годов у учёных и врачей уже есть понимание того, как образуется раковая клетка, но до 2010 года научное сообщество недооценивало роль иммунитета в данном процессе. Изначально было установлено, что раковая клетка храрактеризуется только 6 составляющими, а именно 6 характеристиками онкогенеза, среди которых:
- -Бессмертие
- -Создание воспаления
- -Активная инвазия и метастазирование
- -Индукция ангиогенеза
- -Уклонение от запрограмированного самоуничтожения
- -Дерегуляция клеточной энергии
В 2011 году ряды пополнило новое свойство, уклонение от иммунной защиты.
Как иммунитет борется с раковыми клетками ?
Иммунная модель из трех фаз, известная как «иммуноредактирование», была предложена Данном в 2004 году.
Фаза устранения — первая фаза иммуноредактирования. Иммуноедитинг.
Иммунная система будет разрушать опухолевые клетки, которые будут распознаваться и разрушаться, в частности CD8 + T-лимфоцитами или NK-лимфоцитами («естественными киллерами»), посредством цитотоксических механизмов, также существует роль для нейтрофилов, которые могут быть противоопухолевыми М1 или проопухолевыми М2.
Фаза элиминации (устранения) продолжается до тех пор, пока несколько трансформированных опухолевых клеток не эволюционируют до состояния, которое позволяет избежать защиты иммунитета. Фаза равновесия будет установлена между опухолевыми клонами, способными выживать при иммунной системе, и опухолевыми клетками, уничтоженными иммунной системой.
Затем наступает фаза уклонения. Клетки, которые избегают иммунного надзора, приобретают больше мутаций, что дает им преимущество в выживании. Они будут размножаться, что приведет к инвазии опухолью.
Как работает иммунная терапия ?
Концепция иммунотерапии состоит в том, чтобы обратить эту тенденцию вспять и перейти от фазы уклонения к фазе ликвидации.
Противоопухолевый иммунный ответ начинается с захвата опухолевых антигенов дендритными клетками. Затем дендритные клетки мигрируют в лимфоузлы и представляют антигены Т-лимфоцитам CD4 и CD8 через ОКГ (основной комплекс гистосовместимости).
В присутствии стимула созревания, такого как OX40, презентация может вызывать противоопухолевый эффекторный ответ Т-лимфоцитов или анергию, если есть ингибирование PDL1 или CTLA4.
Т-лимфоциты, направленные против опухолевого антигена, покидают лимфоузел и направляются к опухолевым клеткам, чтобы атаковать их и вызывать их апоптоз.
Тем не менее, многочисленные механизмы иммуносупрессии могут по-прежнему предотвращать разрушение опухолевой клетки, в частности, посредством присутствия супрессивных миелоидных клеток (MDSC), также существует преагрегация PD-L1 на поверхности раковых клеток, которая ингибирует лимфоциты и другие факторы, такие как VEGF, которые ингибируют диапедез Т-клеток из кровеносных сосудов.
Переориентация иммунитета в сторону противоопухолевой стратегии может быть осуществлена тремя способами:
- способствованием презентации антигена дендритных клеток
- способствованием выработке защитного Т-клеточного ответа
- снижением обхода иммуносупрессивных возможностей опухоли
Радиотерапия и иммунотерапия.
Старые методики радиотерапии.
Лучевая терапия ранее считалась иммунодепрессивной, потому что старые методы лечения охватывали большие области, которые наносили существенный ущерб костному мозгу и циркулирующей крови. Однако стало ясно, что облучение может вызывать множественные формы иммунных реакций больного, особенно при модуляции эффективности лучевой терапии. (Новое поколение аппаратов Versa HD)
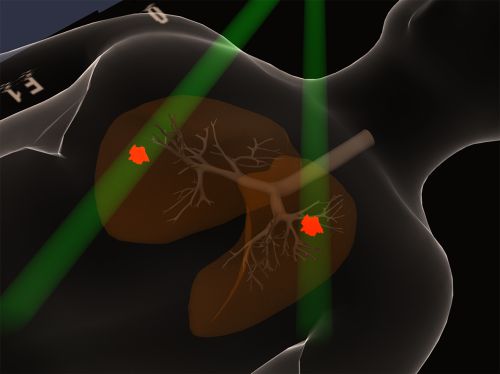
Как работает радиотерапия?
Давно известно, что лимфоциты очень чувствительны к облучению, которое, теоретически, должно проникать в опухоль и тем самым нарушать противоопухолевую иммунную активность.
Основная догма традиционной радиобиологии заключается в том, что цитотоксический эффект лучевой терапии на опухолевые клетки обусловлен разрывом двухцепочечной ДНК и последующей гибелью клеток. Однако в контексте микроокружения опухоли и противоопухолевого иммунитета пациента мы констатируем, что традиционный подход, в современной медицине, уже давно неактуален.
Экспериментальное исследование на мышах показывает, что цитотоксические лимфоциты CD8 необходимы для эффективности лучевой терапии, и также показывает, что лучевая терапия тесно связана с иммунитетом.
В эксперименте использовались мыши, которым была пересажена меланома.
Когда мы облучаем опухоль, неудивительно, что состояние облучённых мышей лучше, чем у необлучённых мышей.
Но когда тот же эксперимент проводят с ‘’голой’’ мышью, это мышь с отсутствующим тимусом, это приводит к ухудшению иммунной системы из-за меньшего количества Т-лимфоцитов. И мы констатируем, что радиотерапия не принесла никакого эффекта.
Если мы возьмем мышь WT с её тимусом, предварительно, истощив её резерв CD8 лимфоцитов, получалось, что в отсуствии лимфоцитов, лучевая терапия теряла свой противоопухолевый эффект.
Таким образом, это исследование является подтверждением концепции, что лучевая терапия не может быть сведена к простому повреждению ДНК.
В радиотерапии огромную роль играет иммунитет, в частности, через лимфоциты CD8.
Связь между лимфопенией и лучевой терапией имеет клиническое доказательство. Недавние наблюдения показали, что лимфопения во время лучевой химиотерапии снижает общую выживаемость при раке пищевода и легких.
Лучевая терапия повышает иммунитет разными способами.
Радиотерапия индуцирует выработку цитокинов и хемокинов в окружающей среде, которые привлекают цитотоксические Т-клетки, макрофаги и дендритные клетки, которые в свою очередь, включают в себя антигены.
Лучевая терапия вызывает цитоплазматическое высвобождение ДНК и РНК, что способствует транскрипции ИФН I типа, в частности, через путь активации STING. Это привлекает и активирует Т-клетки, а так же антиген-презентирующие клетки.
Ионизирующее излучение вызывает иммуногенную гибель раковых клеток с выделением многих нео-антигенов и сигналов, называемых DAMP (кальциретикулин, АТФ, HMGB1), и привлекает антигенпрезентирующие клетки, которые смогут захватывать высвобождаемые антигены и представлять T-лимфоцитам через их MHC, экспрессия которых также будет улучшена радиотерапией.
Лучевая терапия также влияет на другие не иммунные клетки в микро окружении опухоли. В частности, облучение может переформировать васкуляризацию в ангиогенных опухолях, что позволяет улучшить экстравазацию лимфоцитов в опухоли.
Да, но лучевая терапия также будет иметь иммуносупрессивный эффект.
Действительно, цитокины и хемокины также будут привлекать клетки MDSC, супрессивные миелоидные клетки, а также Treg, иммуноингибирующие Т-клетки. Лучевая терапия также будет способствовать привлечению и поляризации нейтрофилов типа М2, которые являются опухолевыми.
Кроме того, длительное воздействие ИФН типа 1 на опухолевые клетки будет вызывать экспрессию PD-L1 на мембране этих клеток, которая будет оказывать иммуносупрессорное действие на Т-лимфоциты.
Иммунная двойственность лучевой терапии показала потенциал комбинаций лучевой терапии и иммунотерапии.
Нельзя говорить о лучевой терапии и иммунитете, не упоминая о знаменитом эффекте abscopal.
Этот эффект был впервые описан Моль в 1953 году.
Концепция заключается в том, что при облучении ракового поражения возникает ответ не только в области облучения, но и в отдаленных местах в соответствии с иммунным механизмом путем иммунизации иммунной системы, в частности, посредством T CD8 против опухолевых клеток.
Не следует путать с эффектом bystander, который является локальным сигнальным механизмом между облученными и необлученными клетками.
Эксперимент показывает, что эффект abscopal опосредован иммунитетом.
Для этого использовалась мышиная модель со слабоиммуногенной сингенной карциномой молочной железы с трансплантатом опухоли на каждый бок, так называемую первичную опухоль, которая была облучена, и так называемую вторичную необлученную опухоль, которая как раз и позволяла измерить эффект abscopal.
Не удивительно, что первичная опухоль ответила на лучевую терапию. Вторичная опухоль не имела ответа.
Затем мышам вводили FTL3-лиганд, фактор роста, который стимулирует и привлекает антигенпрезентирующие дендритные клетки.
Когда FTL3 вводили с лучевой терапией, на вторичную опухоль наблюдали абскопальный эффект.
Кроме того, было доказано, что эффект abscopal специфичен для первичной опухоли, была также создана модель с той же первичной карциномой, что и рак молочной железы, и вторичной опухолью, отличной от лимфомы A20. Во время комбинации лучевой терапии FTL3 не было ответа на вторичную лимфоидную опухоль.
Таким образом, эти результаты позволяют предположить, что эффект лучевой терапии опосредован иммунитетом и, в частности, презентацией антигенов из дендритных клеток, и что данный иммунный ответ специфичен для облученной опухоли.
В традиционной радиобиологии имеются четыре свойства:
- -восстановление клеток
- -перераспределение клеток в цикле
- -репопуляция опухолей
- -реоксигенация опухолей
Сильвия Форменти и её команда зашли немного дальше и стали рассматривать иммунитет к опухолям как 5-е свойство в радиобиологии. Они также сравнили лучевую терапию с противоопухолевой вакцинацией in situ в области облучения.
Как мы видим, лучевая терапия повышает иммунитет и позволяет активировать специфические противоопухолевые Т-лимфоциты. Но существуют также иммуносупрессивные механизмы, индуцированные микроокружением и опухолью, которые позволят опухоли противостоять этому индуцированному иммунитету, в частности на необлученных участках.
Недавняя разработка новых препаратов иммунотерапии позволила надеяться на то, что именно она сможет увеличить проиммуногенный потенциал лучевой терапии, комбинируя её с новыми молекулами.
Резюме.
К сожалению, даже если лучевая терапия стимулирует и активирует появление новых Т-клеток, когда их направляешь против опухоли, они часто не могут преодолеть иммуносупрессивный эффект, индуцированный опухолью и её микроокружением, особенно в не облученных участках опухоли.
Достижения в области иммунотерапии в последние годы открыли новые перспективы в связи лучевой терапией с системными терапиями с потенциалом того, что иммунотерапия может усилить проиммуногенные эффекты лучевой терапии.
Учёным удалось найти выход из сложившейся ситуации, он заключался не в разработке новых препаратов иммунной терапии, а в особой технике облучения.
На сегодняшний день, во Франции активно совмещают радиотерапию и иммунотерапию, однако такой подход возможен исключительно с аппаратами лучевой терапии, оснащённых стереотаксической терапией, то есть ультра точной радиохирургией. Так как для того, чтобы избежать иммуносупрессивный эффект необходимо тщательно избегать облучения лимфоузлов.
Стоит отметить, что первая реакция опухоли при таком виде лечения это массивное прорастание перед смертью. Это называется опухолевой агонией. На снимках можно увидеть эволюцию опухоли во время лечения иммунной терапией и радиохирургией.
Если Вы хотите получить экспертное мнение французских онкологов, а так же получить лечение по последним технологиям и доступным ценам, отправьте свой запрос нам и мы передадим его ведущим докторам Франции.